Es ist immer noch nicht vollständig geklärt, wie das Enzym ß-Lactamase im Bakterium diesen Prozess vollführt. Wichtige Details des Reaktionsmechanismus werden immer noch kontrovers diskutiert. Das Verständnis dieses Mechanismus könnte jedoch dabei helfen, neue Antibiotika zu entwickeln. Leighton Coates und seine Kollegen vom Oak Ridge National Laboratory, USA, haben nun an der Forschungs-Neutronenquelle FRM II den Mechanismus des Enzymes β-lactamase mit Hilfe von Neutronen genauer untersucht.
Sie nutzten hierfür das Diffraktometer BioDiff, das von Andreas Ostermann (FRM II, Technische Universität München) und Tobias Schrader (Forschungszentrum Jülich) gemeinsam betrieben wird. Um die Wasserstoffatome in dem Enzym mit der Neutronendiffraktion besser erkennen zu können, ersetzten die Forscher jedes Wasserstoffatom im Enzym durch sein schwereres Isotop, das Deuterium. So konnten die Positionen dieser Deuteriumatome im aktiven Zentrum des Enzyms bestimmt werden, während dieses ein Antibiotika-Analogon gebunden hält.
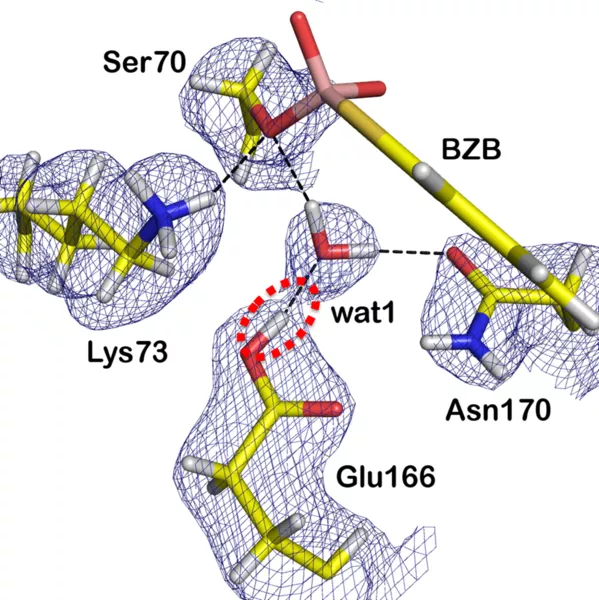
In der Reaktionsabfolge im aktiven Zentrum muss ein Protonenakzeptor vorübergehend ein Proton aufnehmen. Bislang gab es zwei widerstreitende Hypothesen, welche Gruppe im Enzym diese Aufgabe übernimmt. Zahlreiche Studien schlugen die sogenannte Lys-73-Gruppe vor, andere wiederum die Glu-166-Gruppe. Die Neutronenstreuexperimente am BioDiff, die von hochauflösenden Röntgenanalysen ergänzt wurden, zeigten jedoch deutlich, dass die Glu-166-Gruppe als Protonenakzeptor fungiert.
Originalveröffentlichung:
Stephen J. Tomanicek, Robert F. Standaert, Kevin L. Weiss, Andreas Ostermann, Tobias E. Schrader, Joseph D. Ng und Leighton Coates
Neutron and X-ray Crystal Structures of a Perdeuterated Enzyme Inhibitor Complex Reveal the Catalytic Proton Network of the Toho-1 β-Lactamase for the Acylation Reaction
Journal of Biological Chemistry, 288(7):4715-4722, 2013